5 ago. 22
Tiempo estimado de lectura:min
MVA-Imvanex : les atouts d’un « vieux » vaccin antivariolique contre la variole du singe
Jean-Daniel Lelièvre, Inserm1977, le dernier cas connu de variole était enregistré. Trois ans plus tard, le 8 mai 1980, l’OMS prononçait l’éradication mondiale de la maladie. On aurait pu penser que les recherches sur les vaccins dirigés contre le virus responsable de cette infection allaient prendre fin…
Cela n’a pas été le cas, et ce pour plusieurs raisons.
Tout d’abord parce que bien que la maladie ait été éradiquée, le virus de la variole (VARV), lui, ne l’était pas. Des souches existaient (et existent) toujours, conservées dans des laboratoires dédiés et sécurisés – alimentant ainsi la crainte de les voir utilisées comme arme biologique.
Ensuite parce que si la variole dans sa « version » spécifiquement humaine a disparu, d’autres infections ont émergé au cours du XXe siècle, provoquées par des pathogènes de la même famille (poxvirus) : les virus de la Vaccine (VACV), Cowpox (CPXV) et Horsepox qui sont proches et dont les infections restent assez anecdotiques, et le virus Monkeypox (MXV), responsable depuis les années 1970 d’épidémies régulières dont la fréquence tend à augmenter avec le temps.
Enfin parce qu’on a découvert, au début des années 1980, que les vaccins antivarioliques pouvaient être utilisés comme des « plateformes vaccinales » de nouvelle génération, très utiles en vaccinologie moderne. On introduit dans le génome du virus utilisé dans le MVA un bout d’ADN codant pour une protéine d’un autre pathogène (spicule du SARS-CoV-2 par exemple) : après injection du vaccin, cette protéine virale va être exprimée, ce qui va permettre à l’organisme de développer une réponse anticorps protectrice contre celle-ci. Cette technique a été utilisée pour les vaccins anti Covid-19 d’Astra Zeneca et Janssen, qui se sont servis d’adénovirus utilisés comme « plateformes ».
Aux origines d’un vaccin devenu incontournable
Le vaccin contre la variole est, historiquement, considéré comme le premier depuis qu’Edward Jenner en 1798 a recouru à l’injection du virus présent chez la vache (Cowpox) pour protéger contre la variole humaine. Il imaginait ainsi une alternative plus sure et plus efficace à la variolisation (inoculation du « vrai » virus de la variole).
Les techniques de production des vaccins antivarioliques vont ensuite s’industrialiser et abandonner le virus Cowpox pour le VACV. Cultivées sur des peaux d’animaux autres que leur hôte habituel, ces souches virales vont certes conserver leur capacité à provoquer une réaction immunitaire mais devenir moins virulentes : on parle de virus « atténués ». Elles conservent également, malheureusement, la capacité de se répliquer et peuvent poser des problèmes de tolérance et de sécurité des vaccins qui les emploient – tel Dryvax.
La variole étant associée à une lourde mortalité et une lourde morbidité, ces inconvénients ne sont devenus problématiques que lorsque l’incidence de la maladie a commencé à décroître. Ce qui a poussé à rechercher des vaccins plus sûrs.
Dans les années 1970-1980, il n’existait toutefois qu’un seul autre type de vaccin : les vaccins à virus inactivés, sans agent infectieux vivant. Or si ces derniers sont mieux tolérés, ils sont de moins bons immunogènes – l’inactivation (par la chaleur, produits chimiques…) dénaturant ici les éléments viraux nécessaires à l’établissement d’une bonne réponse immunitaire. La technique ne fut donc pas retenue.
L’amélioration des techniques d’atténuation a donc été privilégiée, aboutissant à des vaccins de deuxième puis de troisième générations.
Les vaccins de deuxième génération (tel ACAM 2000) ont été produits via des cultures cellulaires ayant enfin les conditions de stérilité nécessaires. Leur profil de tolérance reste toutefois non optimal, et ils ne peuvent être utilisés chez les sujets immunodéprimés ou souffrants d’eczéma par exemple. Ils représentent cependant la majorité des stocks de vaccins antivarioliques disponibles (les États-Unis ont commandé plus de 200 millions de doses en 1999-2001).
La poursuite des efforts d’atténuation des souches initiales ont conduit à la production de deux souches utilisées pour les vaccins de troisième génération : LC16m8, développé par Kaketsuken au Japon, et MVA (Modified Ankara Vaccine), développé par la société Bavarian Nordic au Danemark.
[Près de 70 000 lecteurs font confiance à la newsletter de The Conversation pour mieux comprendre les grands enjeux du monde. Abonnez-vous aujourd’hui.]
MVA : un vaccin de troisième génération contre la variole humaine…
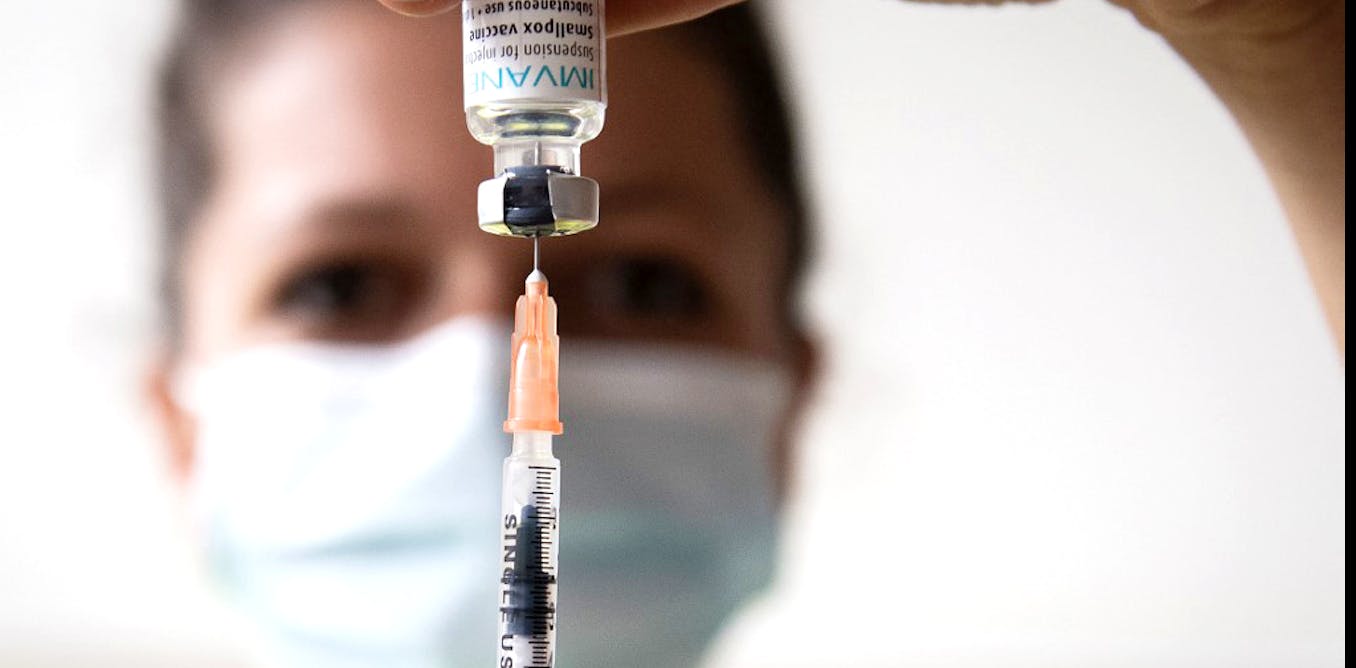
La souche virale utilisée dans le MVA a vu sa virulence largement atténuée suite à sa longue mise en culture sur des cellules d’embryon de poulet. Elle y a perdu une grosse partie de son génome… et la majeure partie de ses effets indésirables.
Bien que produit peu de temps avant l’annonce de l’éradication de la variole, le vaccin a pu être utilisé sur le terrain, ayant obtenu en 1977 une autorisation de mise sur le marché en Bavière (Allemagne). Il est actuellement disponible sous différentes appellations selon les régions/pays : Imvanex en Europe, Imvamune au Canada et Jynneos aux États-Unis.
Son excellent profil de tolérance a ainsi pu être observé chez les plus de 120 000 personnes auxquelles il a été administré avant l’arrêt de la vaccination antivariolique. Contrairement aux vaccins des générations précédentes, le MVA n’induit pas de réaction cutanée lorsqu’il est administré par scarification. Les études cliniques ont toutefois montré que la méthode optimale était l’injection sous-cutanée.
Mais sa bonne tolérance allait-elle de pair avec une bonne efficacité ? Des études d’immunogénicité ont été effectuées dans un deuxième temps. Sept essais cliniques ont ainsi été réalisés (essais Pox-MVA-005, 006, 008, 011, 013, 023, 024). Ils ont permis d’inclure près de 7500 sujets d’âge différents, ayant ou non déjà été vaccinés avec un produit d’une génération antérieure, présentant ou non des problèmes de santé (482 sujets infectés par le VIH inclus dans l’essai Pox-MVA-011), recevant une ou deux (la plupart du temps) doses de vaccin – administré alors 28 jours après la première.
L’objectif principal de ces essais était d’analyser la capacité d’induire une réponse anticorps neutralisante. Les résultats ont été positifs : une seule dose suffisait chez les sujets ayant été vaccinés dans l’enfance contre la variole, deux étaient nécessaires chez les sujets vierges de vaccination (chez eux, une dose permettait d’induire une réponse anticorps au bout de deux semaines, mais elle n’atteignait son plateau que deux semaines après la deuxième dose).
À noter que s’il n’a pas été possible d’apprécier son efficacité clinique réelle, elle a pu être abordée de manière indirecte : dans l’essai MVA-Pox-006, la réaction cutanée induite par un autre vaccin (ACAM 2000) a été atténuée par l’injection du MVA.
… efficace aussi contre la variole dite « du singe »
L’efficacité du MVA contre la variole dite du singe (provoquée par le virus Monkeypox) a d’abord été suggérée de manière indirecte.
Elle pouvait être suspectée, sachant que le vaccin utilisé contre la variole humaine est déjà dérivé d’un virus présent chez l’animal. Puis, un premier cas d’infection par le virus Monkeypox a été observé scientifiquement : survenue chez un enfant non vacciné contre la variole, la maladie ne s’est pas propagée chez ses proches vaccinés dans le passé.
Cette protection s’est ensuite amenuisée au fil du temps, à mesure que les dernières campagnes de vaccination contre la variole s’éloignaient. Ainsi, si on estimait la protection induite par la vaccination antivariolique à environ 85 % en Afrique dans les années 1980 (soit environ cinq ans après l’arrêt de la vaccination antivariolique), une étude de 2003 aux États-Unis (soit 33 ans après) menée après une épidémie a montré que la protection avait largement chuté. Seuls 24 % des cas ayant contracté le MKP avaient été vaccinés contre la variole.
Les données d’efficacité du MVA ont ensuite été obtenues dans les modèles animaux, notamment chez les macaques. Vaccinés, ces singes sont protégés de toute issue fatale.
Enfin, entre 2017 et 2019, 1600 volontaires ont été inclus dans un essai de phase 2 en République démocratique du Congo visant à étudier la réponse immunitaire anti-virus Monkeypox du MVA. Outre la confirmation de la très bonne tolérance du vaccin, l’essai a prouvé l’induction d’une réponse d’anticorps neutralisants anti-virus Monkeypox efficace avec un pic de production au jour 42 (14 jours après la deuxième dose). Il était suivi d’une diminution rapide chez les participants jamais vaccinés, et d’un maintien à des niveaux plus stables chez ceux qui avaient été vaccinés dans l’enfance avec diminution lente jusqu’à deux ans après l’injection.
Quelle stratégie vaccinale adopter ?
Si le vaccin MVA semble efficace contre l’infection par le virus Monkeypox, la question se pose de son utilisation pratique dans le contexte d’une flambée épidémique telle que nous la connaissons actuellement : plus de 25 000 cas à l’échelle mondiale, dont 2239 en France début août.
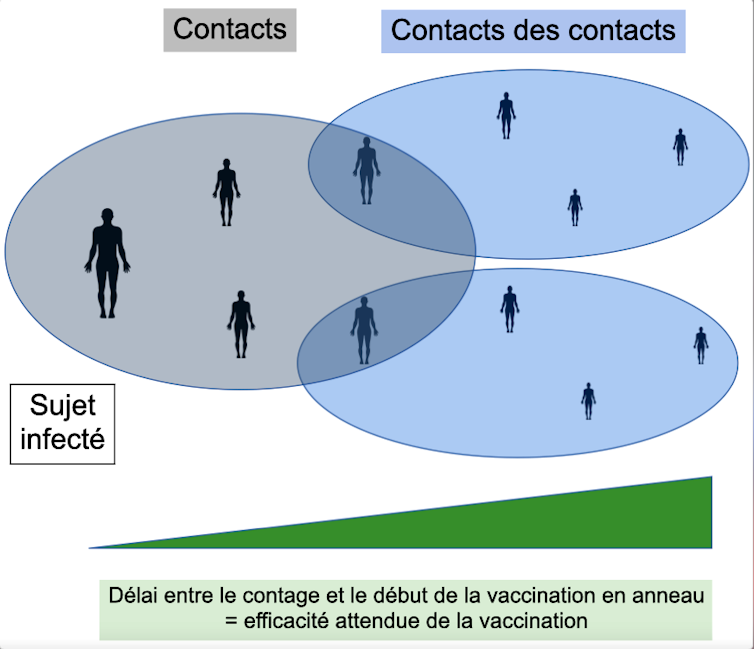
Les stratégies de vaccination développée contre la variole, notamment celle dite « en anneau », ont également été utilisées avec les vaccins contre le méningocoque, les oreillons et, plus récemment, Ebola.
L’objectif de cette stratégie est de stopper la propagation de la maladie en ne vaccinant que les individus les plus susceptibles d’être infectés. Elle passe par l’identification de qui une personne contaminée est susceptible d’infecter ou d’avoir infecté, et d’avoir à disposition pour ces contacts des vaccins fournissant une prophylaxie post-exposition – c’est-à-dire capable d’induire une réponse immunitaire protectrice rapide (pour leur éviter de développer la maladie s’ils ont été contaminés).
Les stratégies de vaccination en anneau intègrent généralement également les contacts des contacts, pour essayer de contenir au mieux l’infection.
Quel est le niveau de protection obtenu ?
Les données disponibles montrent que les anticorps antivarioliques administrés par voie intramusculaire permettent de prévenir l’infection chez les sujets qui avaient des contre-indications à la vaccination avec des vaccins de première et deuxième générations.
Ce rôle important des anticorps a été confirmé chez le macaque, chez qui la déplétion des lymphocytes B – aboutissant à celle des anticorps – après vaccination abolit la protection contre une infection par le virus Monkeypox.
Nous avons vu que la réponse anticorps n’atteignait son pic qu’après la deuxième dose. Or, cela semble impliquer qu’une vaccination post-infection n’a pas d’intérêt… puisque le délai d’induction de la réponse optimale (42 jours) est supérieur au temps d’incubation de la maladie (5 à 21 jours).
Plusieurs éléments permettent de tempérer cette première conclusion hâtive.
Tout d’abord, un délai important ne remet pas en cause la stratégie en anneau. Si la réponse anticorps est maximale à J+42, cela ne veut pas dire qu’elle n’apparaît pas plus tôt et n’est pas efficace plus précocement chez certains sujets.
Par ailleurs, pour importante qu’elle soit, la réponse anticorps n’est pas la seule à prendre en compte. La protection suite à une vaccination peut aussi être portée par une réponse anticorps non neutralisante (non étudiée dans le contexte Monkeypox mais pour laquelle on dispose de données pour les vaccins contre le Covid-19), la réponse lymphocytaire T ou la réponse immunitaire innée. L’injection du MVA est aussi associée à l’induction d’une forte réponse immunitaire innée de type interféron (efficace contre les infections virales) bien supérieure à celle suivant l’administration de vaccins antivarioliques de deuxième génération.
Une dose unique de MVA s’est avérée susceptible de protéger les macaques contre une infection sévère avec le virus Monkeypox dès le quatrième jour suivant la vaccination.
Toutefois, deux éléments importants sont à prendre compte. Premièrement, la dose de vaccin utilisée est importante puisqu’elle est la même que chez l’Homme et le macaque, alors que le poids de ce dernier est en moyenne dix fois inférieur. Deuxièmement, si la première dose protège d’une l’évolution fatale, elle ne protège pas de l’infection comme le montrent les lésions cutanées développées.
Dès lors, il est difficile de conclure quant à l’efficacité de la seule vaccination en anneau.
Devant la difficulté de sa mise en place et la nécessité de l’induction d’une protection tant individuelle que collective, une vaccination des populations les plus touchées actuellement (hommes ayant des relations sexuelles avec des hommes ou HSH, personnes trans avec des partenaires sexuels multiples, personnes en situation de prostitution, professionnels des lieux de consommation sexuelle) a rapidement été mise en place. (Le ministre de la Santé, François Braun, ayant déclaré que « la France avait de quoi vacciner la population cible (…), à savoir 250 000 personnes » ; plus de 16 000 injections ont déjà été réalisées, ndlr).
Quel futur pour la vaccination anti-Monkeypox ?
Le MVA s’impose donc comme un acteur déterminant de la lutte contre l’infection par le virus Monkeypox.
Si son efficacité biologique est plutôt bien évaluée, la vaccination large de la population actuellement la plus concernée par l’infection permettra d’apprécier précisément son efficacité clinique et aidera à déterminer les corrélats de protection induits par la vaccination, c’est-à-dire définir si un dosage biologique (anticorps neutralisant le plus souvent) permet de prédire la protection clinique.
Des études restent à mener pour préciser les modalités les plus pertinentes de la vaccination. Si les études chez l’animal ont montré qu’un intervalle trop court entre deux doses était préjudiciable à l’induction d’une bonne réponse anticorps, on ne connait pas le délai optimal entre celles-ci. Il faudra également déterminer le nombre de doses nécessaires chez les sujets immunodéprimés, et préciser comment générer une réponse à long terme.
Il n’est pas à exclure non plus, enfin, que la recherche doivent envisager la mise au point de nouveaux vaccins, malgré les difficultés inhérentes à ce virus. L’émergence de nouvelles épidémies restant en effet possible…![]()
Jean-Daniel Lelièvre, PU-PH chef de service - directeur du département clinique du VRI - Expert vaccin HAS, OMS, EMA, Inserm
