11 Jul 22
Estimated reading time:min
Entre muscle et nerf : comprendre la jonction neuromusculaire pour mieux comprendre le mouvement

Quoi de plus naturel, a priori, que bouger ? Le moindre geste nous est si simple qu’on ne réalise pas toute la mécanique, tant musculaire que nerveuse, qui se cache derrière. On n’en réalise l’importance que lorsqu’elle se brouille.
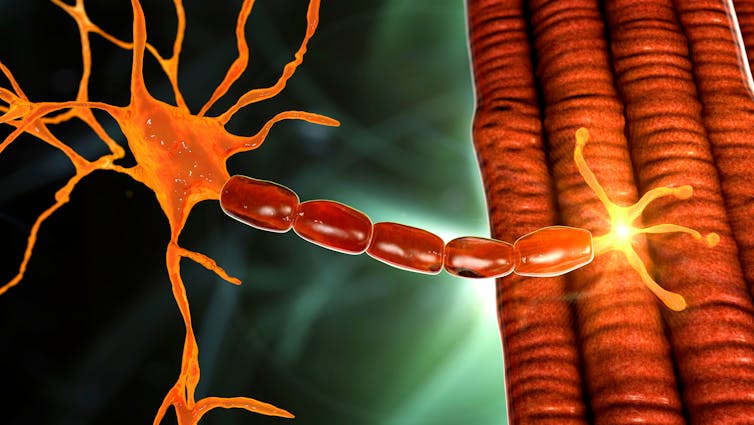
Tous nos mouvements volontaires tels que la respiration, la marche, la parole et l’alimentation, et donc la plupart de nos comportements et notre bien-être, dépendent du bon fonctionnement de la zone physique où nerf et muscle, la pensée et l’action, communiquent : il s’agit de la jonction neuromusculaire (JNM), interface où les neurones dits « moteurs » rencontrent les muscles qui pilotent l’initiation et le contrôle précis du mouvement.
Tout dysfonctionnement au niveau de cette jonction peut entraîner des pathologies importantes, aux répercussions immenses. Ceci tant au niveau des individus concernés que de la société dans son ensemble, en raison du handicap moteur engendré par la perte de mobilité, ainsi que des coûts humain et économique inhérents.
Parmi les atteintes les mieux documentées, on compte une maladie auto-immune appelée myasthénie, la sclérose latérale amyotrophique (ou maladie de Charcot) et la fonte musculaire liée à l’âge (sarcopénie) qui touche cette fois toute la population. Autant d’affections qui dont les ressorts restent non résolus en partie en raison du manque de connaissances.
Les défauts de communication entre nerf et muscle sont une des causes à ces pathologies. On sait qu’elles surviennent principalement lorsque le nerf ne parvient pas à établir un contact avec la surface des muscles, mais il existe d’autres raisons à explorer – tout comme les origines de ces anomalies. Avec notamment pour objectif la conception d’options thérapeutiques. S’il en existe déjà certaines pour l’ensemble des patients, leur efficacité demeure encore limitée.
Mieux comprendre les mécanismes sous-jacents à la formation et au maintien de la jonction neuromusculaire tout au long de la vie est ainsi essentiel à la compréhension de la genèse des pathologies neuromusculaire.
En raison de sa simplicité relative, de sa grande taille et de son accessibilité, la jonction neuromusculaire est un modèle de choix pour étudier comment la communication entre nerf et muscles est régulée pour sous-tendre notre capacité à contracter nos muscles, à bouger notre corps ou simplement à respirer. Des connaissances essentielles pour comprendre comment le système nerveux assure le lien entre les pensées et les actions, en relayant des messages qui voyagent si vite que nous ne les remarquons même pas.
Comment fonctionne la jonction neuromusculaire
Cette zone de contact entre nerf et muscle est constituée d’innombrables « synapses », où un nerf établit un contact avec sa cible (un autre nerf, ou ici un muscle). Une synapse se décompose en plusieurs compartiments : deux zones pré et post-synaptiques, séparées par la « fente synaptique ».
La bonne coordination de ces espaces est cruciale… et pas si évidente.
Car les messages envoyés par le cerveau voyagent sous forme d’impulsion électrique le long des nerfs mais doivent être « traduits » temporairement sous forme chimique à chaque « bifurcation » – changement de nerf ou passage du nerf au muscle. Cette traduction se fait justement au niveau des synapses. Au niveau de la jonction neuromusculaire, le messager chimique qui permet de transmettre l’influx nerveux vers les cellules musculaires et de déclencher le mouvement est l’acétylcholine.
Toute perturbation de cette coordination transsynaptique entraîne la rupture progressive des connexions avec des impacts majeurs sur les fonctions motrices. La difficulté ou l’impossibilité du nerf à établir un contact avec les récepteurs à l’acétylcholine localisés à la surface des muscles est une des défaillances de communication principales.
Une nouvelle voie de communication mise en évidence
En utilisant un large panel d’approches cellulaires et de modèles expérimentaux, notre équipe a étudié une nouvelle voie de communication nerf/muscle. Nous nous sommes tout particulièrement intéressés à une protéine appelée Vangl2, exprimée au niveau de la jonction neuromusculaire.
Nous avons montré, dans notre dernière étude publiée le 17 mai 2022, que cette protéine joue un rôle critique à la fois au cours du développement embryonnaire (au moment de la formation de la jonction neuromusculaire) mais aussi au stade adulte, pour maintenir son fonctionnement normal. Dans nos modèles de souris, nous avons notamment découvert que l’absence de Vangl2 dans les muscles avait un impact délétère sur la transmission des messages au niveau de la jonction neuromusculaire, et engendrait des déficits de la fonction motrice chez les animaux.
Ce qui nous a permis d’identifier Vangl2 comme un acteur clé dans la mise en place des synapses. Nos résultats éclairent également les mécanismes moléculaires sous-jacents à l’assemblage de la JNM elle-même.
Toutes ces nouvelles données ont un intérêt fondamental, pour comprendre comment la jonction neuromusculaire acquiert sa morphologie complexe ; mais elles devraient aussi permettre le développement de nouvelles cibles thérapeutiques pour combattre les maladies neuromusculaires causées par ses dysfonctionnements.
[Près de 70 000 lecteurs font confiance à la newsletter de The Conversation pour mieux comprendre les grands enjeux du monde. Abonnez-vous aujourd’hui.]
Des applications thérapeutiques à venir
La protéine Vangl2 pourrait en effet constituer une nouvelle cible pour la conception de stratégies thérapeutiques innovantes visant à rétablir les anomalies de la jonction neuromusculaire impliquées dans diverses pathologies neuromusculaires. Une piste serait via la modulation de la voie de signalisation associée à Vangl2 pour restaurer la perte de connexions synaptiques dans un contexte pathologique.
Une autre piste, que nous pouvons explorer grâce à la transversalité de notre équipe, serait l’identification à court ou moyen terme de mutations dans le gène codant la protéine Vangl2 dans des cohortes de patients atteints de pathologies génétiques neuromusculaires dont la cause reste non identifiée.
L’affection principale concernée par ces recherches est la myasthénie congénitale, maladie génétique rare affectant la transmission neuromusculaire. Pour cette maladie, il y a environ 35 % de patients qui n’ont pas de diagnostic moléculaire (le gène en cause n’est pas connu).
Les progrès réalisés dans ces domaines devraient avoir un impact à plus long terme sur la compréhension des mécanismes fondamentaux régulant l’établissement et le maintien des connexions entre les nerfs et les muscles tout au long de la vie. Ils pourraient fournir de nouvelles perspectives thérapeutiques pour les maladies héréditaires ou acquises rares qui affectent les connexions neuromusculaires, ainsi qu’aider le développement de nouvelles thérapies régénératives pour les lésions nerveuses.![]()
Laure Strochlic, Research associate, PhD in Neurosciences, Inserm
