10 Oct 22
Estimated reading time:min
Quelles nouvelles approches pour faire reculer l’insuffisance cardiaque avancée ?
Marie Coris, Université de Bordeaux et Pierre Dos Santos, Université de BordeauxDavid Bennet, 57 ans, atteint d’insuffisance cardiaque au stade terminal, a (sur)vécu deux mois début 2022 avec un cœur de porc génétiquement modifié. Pour la première fois, une xénogreffe (le greffon est prélevé chez un donneur d’une autre espèce biologique que celle du receveur) du cœur n’était pas immédiatement rejetée.
Cette réussite inédite est porteuse d’espoir car, lorsqu’elle atteint un stade avancé, l’insuffisance cardiaque laisse très peu d’espoir au patient dont le pronostic vital est engagé dans l’année. Quelles pistes et quelles innovations existent aujourd’hui pour faire reculer une maladie qui touche 2,3 % de la population adulte française et 10 % des plus de 70 ans ?
Insuffisance cardiaque (IC) et insuffisance cardiaque avancée (ICA)
Le cœur est un muscle creux agissant comme une pompe : il se remplit du sang conduit par les veines (relaxation) qu’il éjecte ensuite vers les artères (contraction). Vitale par excellence, sa fonction est d’assurer le débit sanguin nécessaire pour apporter, à l’ensemble des cellules de l’organisme, l’oxygène et les nutriments dont elles ont besoin.
On parle d’insuffisance cardiaque lorsque ce débit est trop faible ou obtenu au prix d’une augmentation anormale de la pression de remplissage du cœur. Il en découle un ensemble de symptômes et de signes cliniques particulièrement invalidants. Les principales causes sont la maladie coronarienne (infarctus du myocarde), la myocardiopathie (dite dilatée kynopinétique idiopathique), l’hypertension artérielle et les valvulopathies.
Cette maladie est fréquente : en France, le nombre de patients dépasse le million et les décès sont estimés à 70 000 par an. Du fait du cours évolutif de l’insuffisance cardiaque, les patients nécessitent des hospitalisations fréquentes (environ 150 000 hospitalisations par an en France). Surtout, on ne guérit pas de l’insuffisance cardiaque… Environ 50 % des patients meurent dans les trois années qui suivent le diagnostic.
L’insuffisance cardiaque est qualifiée d’avancée lorsque les symptômes sont tels qu’ils empêchent désormais le patient d’accomplir le moindre effort (s’habiller, faire sa toilette, marcher quelques mètres en terrain plat, etc.). À ce stade, le traitement médicamenteux est mis en échec. Seule solution : la greffe cardiaque ou, faute de mieux, l’implantation d’un dispositif mécanique d’assistance de longue durée. Selon les données de l’agence biomédecine, en France et en 2020, l’âge moyen des patients au moment de leur transplantation était de 46 ans.
Les limites de la transplantation cardiaque
La transplantation est aujourd’hui le traitement de référence de l’ICA. On peut considérer que ses résultats sont bons. En effet, la survie à un an après l’opération est d’environ 90 % et la qualité de vie des patients est profondément améliorée. Néanmoins, la possibilité de proposer une greffe cardiaque se heurte à de nombreuses limites.
En premier lieu, la pénurie de greffons. Il y a approximativement, en France, deux patients en attente pour un greffon. 15 % décèdent dans l’année faute de greffons. Autres limites, les comorbidités : certaines maladies pulmonaires, une obésité morbide ou des atteintes sévères d’autres organes comme le foie ou le rein. Toutes augmentent le risque d’échec de la greffe ou d’incompatibilité avec le traitement immunosuppresseur que devra prendre le transplanté.
D’autres facteurs, qui ne vont pas sans poser des questions éthiques très délicates, s’opposent fréquemment à la transplantation : les conduites addictives du receveur (tabagisme actif ou consommation excessive d’alcool par exemple) et les « conditions psychosociales » susceptibles de compromettre un suivi optimal du patient après la transplantation.
Enfin, et de manière très brutale, l’âge entre également en ligne de compte : il est communément accepté, en France, de ne pas transplanter au-delà de l’âge de 65 ou 70 ans. Le greffon cardiaque étant une ressource particulièrement rare, il faut, dans une démarche utilitariste, gérer sa pénurie en favorisant l’accès aux patients les plus graves, les plus stables psychologiquement, les plus disciplinés (on parle de compliance) et dont l’insuffisance cardiaque est, idéalement, le seul problème.
Pallier ces limites et maintenir en vie les patients en attente d’un greffon ont été le moteur de recherches visant à développer les dispositifs médicaux que sont le cœur artificiel total et les dispositifs d’assistance cardiaque de longue durée. Leur finalité ? Remplacer le cœur défaillant ou l’assister « mécaniquement ».
[Près de 80 000 lecteurs font confiance à la newsletter de The Conversation pour mieux comprendre les grands enjeux du monde. Abonnez-vous aujourd’hui]
Les dispositifs médicaux : une solution « faute de mieux » ?
En l’état de son développement par la société française CarMat, le cœur artificiel total fait encore face à de nombreux aléas quant à sa mise sur le marché. En revanche, les Dispositifs d’assistance circulatoire mécanique (DACM) longue durée sont une réalité.
À l’heure actuelle, le recours à ces dispositifs n’est envisagé que pour les cas les plus graves lorsqu’aucune autre solution n’est envisageable. Le marché est actuellement dominé par Abbott, avec le HeartMate 3TM, une mini turbine, implantée dans le thorax, qui aspire le sang du ventricule gauche du cœur et l’éjecte dans l’aorte ascendante.
Contrairement au cœur qui génère un débit pulsatile, cette pompe génère un débit « non physiologique » en continu. Sa turbine est connectée, via un câble s’abouchant à la peau de l’abdomen, à un « contrôleur » (permettant d’afficher les paramètres) et à une batterie que le patient porte à la ceinture.
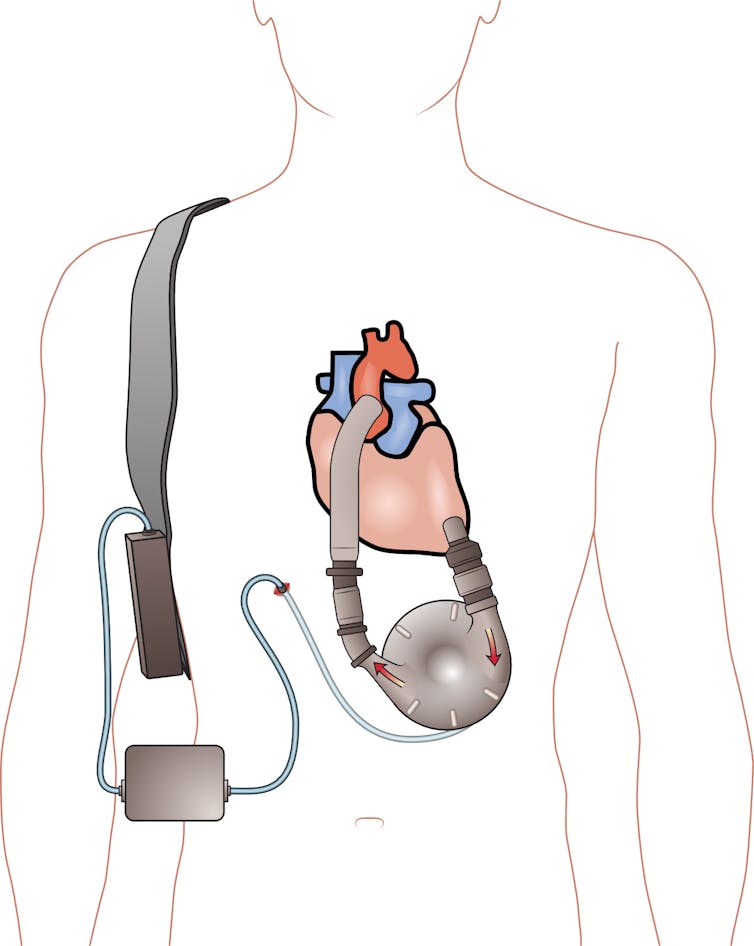
Même si les patients appareillés retrouvent une qualité de vie ambulatoire acceptable, ils sont soumis à des contraintes fortes liées à la bonne utilisation des batteries et à des conditions d’hygiène très rigoureuses. Malgré ces précautions, des complications infectieuses surviennent chez 58 % d’entre eux.
Et d’autres complications sont susceptibles de survenir dans les deux ans suivant l’implantation : notamment des thromboses liées à la formation de caillots sanguins (15,7 % des patients avec HeartMate 2, 1,1 % pour le HeartMate 3) et saignements digestifs (pour partie conséquence du caractère continu du débit ; 33,1 % des patients équipés d’un HeartMate 3, 39,1 % pour le HeartMate 2).
Globalement toutefois, la vie des patients appareillés est transformée et, deux années après l’implantation, près de 75 % d’entre eux sont vivants et n’ont pas présenté d’accident thromboembolique avec séquelle et/ou de dysfonctionnement de la pompe. Ces résultats sont proches de ceux de la greffe.
Vers une nouvelle génération de dispositifs médicaux ?
Le DACM est aujourd’hui une solution acceptable… en partie parce qu’elle est la seule pour les patients non éligibles à la transplantation ou dont la sévérité de la maladie ne leur permet pas d’attendre (risque de mort ou d’altération d’autres organes). Mais il n’est pas pleinement satisfaisant.
La recherche se mobilise pour innover afin d’améliorer la qualité et l’espérance de vie des personnes concernées – on parle de balance bénéfice-risque. Les chiffres l’ont rappelé en introduction, il y a aussi un grand développement possible. Avec des dispositifs moins invasifs et des interventions chirurgicales moins lourdes, on pourrait en effet espérer un élargissement de la patientèle éligible.
De nombreuses start-up travaillent à faire évoluer les dispositifs disponibles. Se débarrasser du câble reliant le dispositif (interne) à la batterie (externe) est l’un des principaux moteurs de cette course à l’innovation. Parmi les avancées majeures ces dernières années, la quête d’un système rechargeable par « TET » (Transcutaneous Energy Transfer). Comprenez un rechargement par induction à travers la peau, donc sans fil, sur laquelle se positionnent des Abbott et Medtronic (leaders sur le marché) mais également des jeunes pousses comme Leviticus (Israël), FineHeart (start-up française) ou Syntach (Suède).
L’utilisation de la recharge par transfert d’énergie transcutanée requiert cependant de concevoir des dispositifs consommant beaucoup moins d’énergie que le HeartMate 3. Apparaît alors une piste d’amélioration complémentaire explorée par certaines start-up (CorWave et FineHeart en France, Nuheart en Norvège) : préserver l’aspect physiologique (le débit pulsatile) de la pompe.
En effet, le débit pulsatile permettrait de réduire la consommation d’énergie de la pompe, et donc la taille des batteries et des dispositifs. La miniaturisation pourrait en outre avoir un impact positif sur l’éligibilité des patients, le type d’intervention chirurgicale (pas d’ouverture du thorax) et sur le système de chargement car le TET deviendrait une réalité.
Sans compter que réussir à restituer un débit plus naturel permettrait également une réduction des effets indésirables et une forme de rééducation du cœur malade.
Les biotechs, un nouvel espoir ?
10 000 transplantations cardiaques ont lieu chaque année dans le monde alors qu’on recense deux millions de personnes atteintes d’ICA rien que pour l’Europe et les États-Unis. L’alternative à la transplantation que représentent les DACM est nécessaire, mais en l’état les solutions proposées ne sont pas encore pleinement satisfaisantes.
Face à la pénurie de greffons, à l’incertitude des xénogreffes et aux limites des DACM, une autre piste semble s’ouvrir, celle des biotechnologies – avec utilisation ou modification de matériaux vivants pour développer des traitements. La thérapie cellulaire consiste par exemple à insérer dans le cœur du patient atteint d’IC des cellules pouvant se différencier en cellules cardiaques afin de compenser le déficit présent.
Les principaux acteurs à l’œuvre sont pour l’heure des organismes publics de recherche. Si la technique est prometteuse, il faudra encore quelques années pour trouver une solution optimale visant à régénérer les cellules cardiaques.
Mais à l’avenir, cette approche pourrait révolutionner les traitements de l’ICA : en plus d’augmenter l’éligibilité des patients, cette thérapie pourrait permettre une prise en charge de l’insuffisance cardiaque à des stades plus précoces, évitant l’évolution de la pathologie vers le stade avancé. Certaines start-up (CellProthera, Cardio3 BioScience par exemple) se positionnent d’ores et déjà sur le secteur. Affaire à suivre donc…
Robin Pointet, étudiant du Master Intelligence économique de l’université de Bordeaux, a également contribué à la conception et à la rédaction de cet article.![]()
Marie Coris, Enseignant-chercheur économie de l’innovation, laboratoire GREThA, Université de Bordeaux et Pierre Dos Santos, Professeur des Universités en physiologie à l'Université de Bordeaux et Praticien Hospitalier en Cardiologie au CHU, Université de Bordeaux
