4 Nov 22
Geschätzte Lesezeit:min
Les virus bactériophages : alliés ou ennemis dans la lutte contre les infections bactériennes ?
Baptiste Arbez, Université de Lorraine et Sofiane El-Kirat-Chatel, Université de LorraineUne famille de virus, les bactériophages, a la particularité d’être à la fois un ennemi néfaste qui contribue à la résistance aux antibiotiques des bactéries mais également un allié précieux dans la lutte contre les infections bactériennes. Comprendre le fonctionnement biologique complexe de ces virus est primordial pour pouvoir développer des alternatives aux antibiotiques.
Les bactériophages (ou simplement phages) sont des virus qui ont la capacité d’infecter les bactéries et, dans la plupart des cas, de les tuer. Ils représentent l’entité biologique la plus abondante sur Terre et sont présents partout. Il y aurait dix fois plus de phages que de bactéries sur la planète. Ces derniers sont essentiels à la biosphère puisqu’ils assurent son équilibre en évitant toute prolifération démesurée et incontrôlée des bactéries.
Comme tous les virus, ils ont besoin d’infecter une cellule hôte pour se reproduire. Lors de l’infection d’une bactérie, ils peuvent adopter deux cycles de reproduction différents : le cycle lytique et le cycle lysogénique. Le cycle lytique permet aux phages de détourner la machinerie cellulaire pour produire de nouvelles particules virales. L’accumulation de ces dernières provoque la rupture de la paroi des bactéries infectées, ce qui libère de nouveaux phages libres d’infecter à leur tour d’autres cellules. Les phages lytiques sont les plus agressifs et conduisent à la mort rapide des cellules infectées.
Grâce à leur capacité à tuer rapidement et de façon ciblée les bactéries, les phages lytiques ont été utilisés comme stratégie thérapeutique contre les infections bactériennes : la phagothérapie. Cette dernière a montré son efficacité des années avant la découverte de la pénicilline pour traiter des cas de peste, de dysenterie et de choléra au début du XXe siècle. Mais la phagothérapie a rapidement été éclipsée par la démocratisation des antibiotiques, moins onéreux et plus faciles à produire.
Le cycle lysogénique est, quant à lui, souvent considéré comme un cycle de « dormance » où le phage introduit son génome viral (ou prophage) dans le génome bactérien sans tuer la cellule hôte. Lorsque le prophage est activé par des stimuli extérieurs (comme de la lumière ultra-violette), il s’extrude de l’ADN de la cellule hôte, se multiplie et entre dans un cycle lytique comme décrit précédemment. Cependant, il arrive que le prophage commence à se multiplier avant de s’extruder de l’ADN hôte.
[Près de 80 000 lecteurs font confiance à la newsletter de The Conversation pour mieux comprendre les grands enjeux du monde. Abonnez-vous aujourd’hui]
En se multipliant, il réplique des fragments plus ou moins longs de l’ADN de la bactérie hôte en plus de répliquer son propre génome. Ces fragments d’ADN bactérien peuvent se retrouver encapsulés dans les nouveaux phages et être transmis à d’autres bactéries lors d’un nouveau cycle d’infection. C’est le phénomène de transduction latérale, le cycle lysogénique est donc responsable du transfert horizontal de gènes. Autrement dit, les phages lysogéniques sont capables de transmettre des gènes entre les bactéries sans que celles-ci soient des descendantes directes.
L’utilisation massive et systématique d’antibiotiques ces dernières décennies a favorisé l’apparition de gènes de résistance et les phages lysogéniques contribuent intensivement à la propagation rapide de ces gènes de résistance aux antibiotiques à travers les populations bactériennes par transduction via les prophages. Il existe donc une dualité entre les phages lytiques, de précieux alliés pour lutter contre les infections bactériennes, et les phages lysogéniques, des ennemis néfastes qui participent activement à l’augmentation du nombre de souches bactériennes résistantes aux antibiotiques.
Comment les phages reconnaissent les cellules à infecter ?
Qu’il soit lytique ou lysogénique, un phage n’infecte que certaines bactéries de façon ciblée et très spécifique. Une partie de nos travaux conduits au laboratoire de chimie physique et microbiologie pour les matériaux et l’environnement (LCPME) de l’Université de Lorraine-CNRS visent à comprendre comment les phages reconnaissent leurs bactéries hôtes pour les infecter.
L’infection commence par la reconnaissance d’une cellule hôte adéquate grâce à des protéines à la surface du phage qui se lient spécifiquement à certains récepteurs à la surface des bactéries et qui permettent l’adhésion du phage sur l’hôte.
Aucune infection n’est possible sans adhésion. La reconnaissance de récepteurs spécifiques par le phage est donc une étape clé. Cependant, beaucoup de zones d’ombre persistent sur son fonctionnement et peu de récepteurs ont été clairement identifiés.
C’est dans ce contexte que notre article scientifique publié dans la revue « Nano Research » en juillet 2022 intervient.
Une nouvelle technique
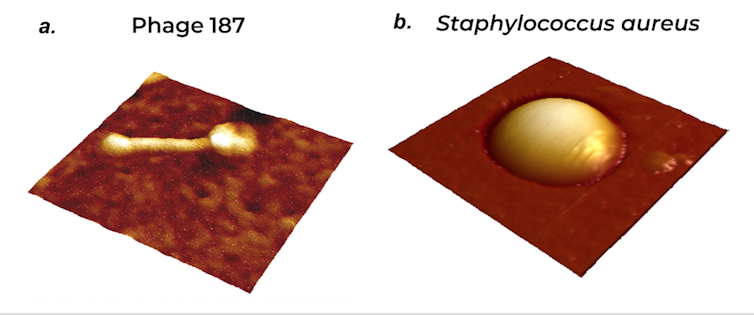
Dans cette publication, nous avons utilisé la microscopie à force atomique (AFM) afin d’identifier les récepteurs du phage 187 (Figure 1a) qui conduisent à l’infection de Staphylococcus aureus (Staphylocoque doré, Figure 1b). S. aureus fait partie des trois agents pathogènes principaux responsables des infections nosocomiales qui touchent en France environ un patient sur vingt.
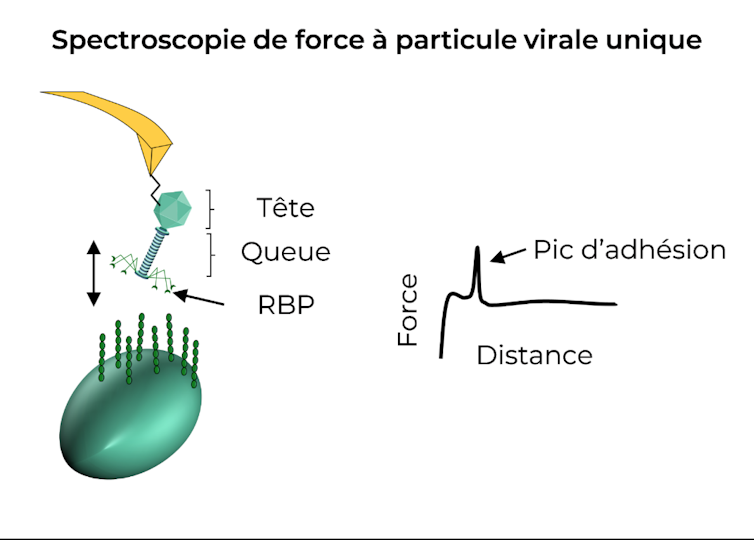
Nous proposons une nouvelle méthode, la spectroscopie de force à particule virale unique (ou « Single-Particule Force Spectroscopy », SPFS) afin de caractériser à l’échelle nanométrique les forces d’adhésion entre les phages et les bactéries.
Pour cela, nous avons greffé et immobilisé un phage à la surface d’une pointe pyramidale dont le sommet ne mesure que quelques nanomètres.
Les pointes ont été utilisées pour scanner les surfaces de bactéries vivantes tout en enregistrant des courbes de forces. Ces dernières permettent d’extraire les forces d’adhésion qui lient le phage à la surface des bactéries. Plus il y a d’adhésion, plus la reconnaissance est forte.
Grâce à cette technique, nous avons identifié un sucre appelé le N-acétylglucosamine qui est un carbohydrate présent dans les parois cellulaires de S. aureus, comme principal récepteur impliqué dans la reconnaissance et donc l’infection de S. aureus par le phage 187.
L’utilisation de la spectroscopie de force à particule virale unique ouvre de nouvelles perspectives pour l’identification à l’échelle nanométrique des récepteurs sans lesquels l’infection des bactéries n’aurait pas lieu. Il s’agit d’une preuve de concept d’une technique permettant d’améliorer notre compréhension des interactions biologiques complexes des phages et qui peut aider les chercheurs à développer de nouveaux traitements efficaces, à utiliser à notre avantage les propriétés de transduction des phages et à limiter les transferts de gènes de résistance aux antibiotiques.![]()
Baptiste Arbez, Chercheur post-doctoral, matériaux pour la santé, LCPME, CNRS-Université de Lorraine, Université de Lorraine et Sofiane El-Kirat-Chatel, Microscopie à Force Atomique, Bio-interfaces, Microbiologie, Université de Lorraine
Nous remercions les auteurs et The Conversation pour l'autorisation de republication.
